हाइड्रोजन एवं इसके यौगिक
Category :
हाइड्रोजन एवं इसके यौगिक
विश्लेषणात्मक अवधारणा
आवर्त सारणी का तत्व हाइड्रोजन ब्रह्माण्ड में अत्यधिक मात्रा में उपस्थित रहता है, जो भविष्य का ऊर्जा स्त्रोत रहेगा एवं पृथ्वी की सतह पर हाइड्रोजन की उपलब्धता तीसरे स्थान पर रहती है। सभी तत्वों में हाइड्रोजन तत्व की संरचना सरलतम होती है, जिसे डाइहाइड्रोजन (\[{{H}_{2}}\]) भी कहते हैं। आवर्त सारणी में हाइड्रोजन वर्ग-1 एवं आवर्त-1 में स्थित रहता है।
हाइड्रोजन / डाइहाइड्रोजन (\[{{H}_{2}}\]) उपलब्धता - हाइड्रोजन ब्रह्मांड के संपूर्ण द्रव्यमान का 70% है। यह सौरमण्डल व वायुमण्डल का प्रमुख तत्व है। बृहस्पति (Jupiter) तथा शनि (Saturn) ग्रहों में अधि कांशत: हाइड्रोजन होती है, अपनी हल्की प्रकृति के कारण यह पृथ्वी के वायुमंडल में कम मात्रा (द्रव्यमानानुसार लगभग 0.15 %) में पाया जाती है। संयुक्त अवस्था में हाइड्रोजन तत्व भू-पर्पटी तथा महासागरों । में 15.4% भाग बनाता है। संयुक्त अवस्था में जल के अतिरिक्त यह पादप तथा जंतु-ऊतकों, कार्बोहाइड्रेट, प्रोटीन, हाइड्राइड, हाइड्रोकार्बन और कर्इ अन्य यौगिकों में पाया जाता है।
क्षार धातुओं से समानता-
(1) क्षार धातुओं का सामान्य इलेक्ट्रानिक विन्यास \[n{{s}^{1}}\] रहता है, जो हाइड्रोजन के इलेक्ट्रानिक विन्यास \[1{{s}^{1}}\] के समतुल्य होता है।
(2) क्षार धातुओं के समान एक इलेक्ट्रॉन का त्याग करके यह \[{{H}^{+}}\] आयन की स्थार्इ संरचना प्राप्त कर धनायन का निर्माण करता है।
(3) क्षार धातुओं के समान हाइड्रोजन की संयोजकता भी 1 होती है।
(4) क्षार धातुओं के सभी यौगिकों में इनकी ऑक्सीकरण संख्या +1 तथा हाइड्रोजन के भी अधिकांश यौगिकों में इसकी ऑक्सीकरण संख्या +1 होती है।
(5) हाइड्रोजन भी क्षार धातुओं के समान अधातुओं से सरलता से संयोग कर लेता है।
(6) हाइड्रोजन भी क्षार धातुओं के समान अपचायक गुण प्रदर्शित करता है।
(7) क्षार धातुओं के हैलाइड तथा हाइड्रोजन के हैलाइड में भी समानता रहती है। जिस प्रकार छंब्स का विद्युत अपघटन करने पर छं आयन कैथोड पर मुक्त होते हैं। उसी प्रकार भ्ब्प् का विद्युत अपघटन करने पर आयन भी कैथोड पर मुक्त होते हैं।
हैलोजनों से समानता
(1) हैलोजनों के समान हाइड्रोजन के भी बाह्यतम कोश में, उत्कृष्ट गैस (He) से एक इलेक्ट्रान कम है। अत: हाइड्रोजन एक इलेक्ट्रान ग्रहण कर निकटतम उत्कृष्ट गैस (He) का स्थार्इ इलेक्ट्रानिक विन्यास (\[1{{s}^{2}}\]) ग्रहण कर लेता है।
(2) हैलोजनों की भांति हाइड्रोजन भी ऋणायन बनाता है। (3) हैलोजनों की यौगिकों में ऑक्सीकरण संख्या -1 होती है। हाइड्रोजन के कुछ यौगिकों में ऑक्सीकरण संख्या -1 होती है! जैसे - LiH में हाइड्रोजन की ऑक्सीकरण संख्या -1 होती है।
(4) हैलोजन अणुओं के समान हाइड्रोजन अणु (\[_{1}{{H}^{2}}\]) भी द्विपरमाणुक होता है।
(5) हेलोजनों के समान हाइड्रोजन भी अधातु तत्व है।
हाइड्रोजन के समस्थानिक- हाइड्रोजन के तीन समस्थानिक प्रोटियम (\[_{1}{{H}^{1}}\]), डîूटीरियम (\[_{1}{{H}^{2}}\]या D) तथा ट्राइटियम (\[_{1}{{H}^{3}}\] या T) होते हैं। ये तीनों समस्थानिक न्यूट्रॉन की संख्या के आधार
पर एक-दूसरे भिन्न होते हैं। सामान्य हाइड्रोजन (प्रोटियम) में न्यूट्रॉन अनुपस्थित होता है। डîूटीरियम (भारी हाइड्रोजन) में एक तथा ट्राइटियम के नाभिक में दो न्यूट्रॉन उपस्थित होते हैं। हाइड्रोजन का प्रमुख समस्थानिक प्रोटियम है।
हाइड्रोजन (\[{{H}_{2}}\]) का निर्माण
प्रयोगशाला विधि
(i) दानेदार जिंक से तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया होने पर हाइड्रोजन गैस का निर्माण होता है
\[Z{{n}_{(s)}}+2{{H}^{+}}_{(aq)}\to Z{{n}_{2}}{{^{+}}_{(aq)}}+{{H}_{2(g)}}\]
(ii) जिंक धातु की जलीय क्षार के साथ अभिक्रिया करके भी बनार्इ जाती है -
\[\underset{lksfM;e ftadsV}{\mathop{Z{{n}_{(s)}}+2NaO{{H}_{(aq)}}\to N{{a}_{2}}Zn{{O}_{2}}_{(aq)}+{{H}_{2(g)}}}}\,\]
हाइड्रोजन के गुण - भौतिक गुण- हाइड्रोजन (\[{{H}_{2}}\]) एक रंगहीन, गंधहीन, स्वादहीन एवं ज्वलनशील गैस होती है। यह वायु से हल्की एवं जल में अविलेय होती है।
रासायनिक गुण - हाइड्रोजन या अन्य किसी अणु का रासायनिक व्यवहार अधिकांशत: बंध वियोजन ऊर्जा पर निर्भर करता है। उच्च H-H बंध ऊर्जा के कारण कमरे के ताप पर डाइहाइड्रोजन (\[{{H}_{2}}\]) अपेक्षाकृत निष्क्रिय होता है। अत: विद्युत आर्क या पराबैंगनी विकिरणों द्वारा परमाण्विक हाइड्रोजन का उत्पादन किया जा सकता है। क्योंकि इसका एक कक्षक \[1{{s}^{1}}\] इलेक्ट्रॉनिक विन्यास के साथ अपूर्ण है, अत: यह लगभग सभी तत्वों के साथ संयोग करता है। हाइड्रोजन अभिक्रियाओं में
(i) एक इलेक्ट्रॉन का त्याग कर \[{{H}^{+}}\] देता है।
(ii) एक इलेक्ट्रॉन ग्रहण करके आयन का निर्माण करता है।
(iii) इलेक्ट्रॉन का साझा करके एकल सहसंयोजक बंध का निर्माण
करता है।
हाइड्रोजन के अनुप्रयोग -
§ हाइड्रोजन का बड़े स्तर पर अनुप्रयोग अमोनिया का निर्माण करने में होता है, जो नाइट्रिक अम्ल तथा नाइट्रोजनी उर्वरक उत्पादन में काम आता है।
§ हाइड्रोजन का उपयोग बहुअसंतृप्त वनस्पति तेलों (जैसे- बिनौला, सोयाबीन आदि) से वनस्पति वसा के उत्पादन में किया जाता है।
§ हाइड्रोजन का उपयोग अनेक कार्बनिक रसायनों, मुख्यत: मेथेनॉल के उत्पादन में किया जाता है-
\[C{{O}_{(g)}}+2{{H}_{2(g)}}\xrightarrow{dksckYV (CO) mRizsjd}C{{H}_{3}}O{{H}_{(I)}}\]
§ इसका उपयोग धात्विक हाइड्राइड, अति उपयोगी रसायन (जैसे- हाइड्रोजन क्लोराइड) के निर्माण में होता है।
§ धातुकर्म प्रक्रमों में हाइड्रोजन का उपयोग भारी धातु ऑक्साइडों को धातु में अपचयित करने में होता है।
§ परमाण्विक हाइड्रोजन तथा ऑक्सी-हाइड्रोजन टॉर्च का उपयोग कर्तन तथा वेल्डिंग में होता है।
§ परमाण्विक हाइड्रोजन परमाणु (H) (जो विद्युत आर्क की सहायता से हाइड्रोजन अणु (\[{{H}_{2}}\]) के वियोजन से बनते हैं) का पुनसर्ंयोग वेल्डिंग की जाने वाली धातुओं की सतह पर लगभग 4000 K तक ताप पैदा कर देता है।
§ हाइड्रोजन का उपयोग अंतरिक्ष अनुसंधान में रॉकेट र्इंधन एवं र्इंधन सेलों के विद्युत उत्पादन में होता है। परंपरागत जीवाश्म र्इंधन तथा विद्युत शक्ति की अपेक्षा में हाइहाड्रोजन का उपयोग र्इंधन के रूप में करने से अनेक लाभ होते हैं। यह र्इंधन प्रदूषण मुक्त है और पेट्रोल तथा अन्य र्इंधन की अपेक्षा में इकार्इ द्रव्यमान से अधिक ऊर्जा का निर्माण करता है।
जल (\[{{H}_{2}}O\])
कुछ पौधों में लगभग 95% एवं मानव शरीर में लगभग 65% जल होता है। यह एक अतिमहत्वपूर्ण विलायक है। पृथ्वी की सतह पर जल का वितरण एक समान नहीं होता है।
विश्व की आकलित जल-आपूर्ति
|
स्त्रोत |
संपूर्ण % मात्रा |
|
महासागर (Oceans) |
97.33 |
|
ध्रुवीय बर्फ (Polar ice) तथा हिमानी (Glaciers) |
2.04 |
|
खारी झील (Saline lakes) तथा अंत: स्थलीय समुद्र (island sea) |
0.008 |
|
भौम जल (Ground water) |
0.61 |
|
झील (संमे) |
0.009 |
|
मृदा-आर्द्रता (Soil Moisture) |
0.005 |
|
वायुमंडलीय जलवाष्प (Atmospheric water vapour) |
0.001 |
|
नदियां (River) |
0.0001 |
जल के भौतिक गुण - यह एक रंगहीन तथा स्वादहीन द्रव है। संघनित प्रावस्था (द्रव एवं ठोस अवस्था) में जल के असामान्य गुणों का कारण जल के अणुओं के बीच हाइड्रोजन बंध होता है। इसी वर्ग के अन्य तत्वों के हाइड्राइड जैसे \[{{H}_{2}}S,{{H}_{2}}Se\] की तुलना में जल का क्वथनांक, वाष्पन ऊष्मा, हिमांक, संलयन ऊष्मा का मान हाइड्रोजन-बंधन (H-Bonding) के कारण उच्च होता है। अन्य द्रवों की तुलना में जल की विशिष्ट ऊष्मा, तापीय चालकता, पृष्ठ-तनाव, द्विध्रुव आघूर्ण तथा परावैद्युतांक के मान उच्च होते हैं। इन्हीं गुणों के कारण जीवमंडल में जल की महत्वपूर्ण भूमिका है। . जल की उच्च वाष्पन ऊष्मा तथा उच्च ऊष्मा. धारिता ही जीवों के शरीर तथा जलवायु के सामान्य ताप को बनाए रखने के लिए उत्तरदायी है। ध्रुवीय अणुओं के साथ हाइड्रोजन बंध बनाता है, जिससे सहसंयोजक यौगिक, जैसे- ऐल्कोहॉल तथा कार्बोहाइड्रेट यौगिक जल में विलेय होते हैं।
जल की संरचना - गैस-प्रावस्था में जल एक कोणीय अणु है। बंध कोण तथा O-H बंध दूरी के मान क्रमश: \[{{104.5}^{o}}\]तथा 95.7 pm हैं।
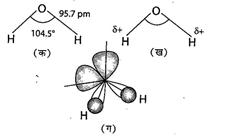
जल का अणु
(क) जल की बंकित संरचना (ख) जल अणु द्विध्रुव के रूप
में और (ग) जल के अणु में आर्बिटल अतिव्यापन
जल का क्रिस्टलीय रूप बर्फ है। वायुमंडलीय दाब पर बर्फ का क्रिस्टलीकरण षट्कोणीय आकृति (Hexagonal Shape) के रूप में होता है लेकिन कम तापमान पर इसका संघनन घनीय (Cube) जैसा होता है। बर्फ का घनत्व जल से कम होता है, जिसके कारण बर्फ जल में तैरता रहता है। सर्दी के मौसम में झील के पानी की सतह पर जमी बर्फ की सतह ऊष्मारोधन (Thermal insulation ) होती है, जिससे जलीय जीवन सुरक्षित रहता है। यह पारिस्थितिकी (Ecological) की ष्टि से महत्वपूर्ण है।
बर्फ की संरचना - बर्फ एक अतिव्यवस्थित त्रिविम हाइड्रोजन
आबंधित संरचना (Highly ordered three dimension hydrogen bonded structure) होती है। X-किरणों द्वारा विश्लेषण करने पर ज्ञात होता है कि बर्फ क्रिस्टल में अॉक्सीजन परमाणु चार अन्य हाइड्रोजन परमाणुओं से 276 pm दूरी पर चतुष्फलकीय रूप से घिरा रहता है। हाइड्रोजन बंध बर्फ में छिद्रयुक्त एक प्रकार की खुली संरचना का निर्माण करते हैं।
कठोर एवं मृदु जल (Hard and Soft water) - सामान्यत: वर्षा का जल लगभग शुद्ध रहता है। (वायुमंडल की कुछ घुलनशील गैसें. घुली हो सकती हैं)। जल का पृथ्वी की सतह पर अस्तित्व उत्तम विलायक के रूप में होता है। यह कर्इ लवणों को विलेय करने की क्षमता रखता है। जल में उपस्थित विलेयशील मैग्नीशियम तथा कैल्शियम लवण (जो हाइड्रोजन कार्बोनेट, क्लोराइड तथा सल्फेट के रूप में रहते हैं) उसकी कठोरता के कारण होते हैं। कठोर जल साबुन के साथ आसानी से झाग नहीं देता है। विलेयशील मैग्नीशियम तथा कैल्शियम लवण से मुक्त जल को मृदु जल (Soft water) कहते हैं। मृदु जल साबुन के साथ आसानी से झाग देता है। कठोर जल साबुन के साथ अवक्षेप देता है। कठोर जल धुलार्इ के लिए उपयुक्त नहीं होता है। यह भाप क्वथित्र (Steam boiler) के लिए भी नुकसान दायक होता है, क्योंकि परत के रूप में इसमें लवण जमा हो जाते हैं एवं भाप क्वथित्र की दक्षता में कम हो जाती है। जल की कठोरता दो प्रकार की होती है -
1. अस्थायी कठोरता - यह जल में कैल्शियम तथा मैग्नीशियम के हाइड्रोजन कार्बोनेट (बार्इकार्बोनेट) की उपस्थिति के कारण होती है। इस कठोरता को सरल विधियों, उबालने और क्लार्क विधि द्वारा दूर किया जा सकता है।
2. स्थायी कठोरता - इस प्रकार की कठोरता जल में घुलनशील कैल्शियम तथा मैग्नीशियम के क्लोराइड तथा सल्फेट के रूप में विलेय होने के कारण होती है। यह (स्थायी कठोरता) उबालने पर हटती नहीं है। इसे निम्नलिखित विधियों द्वारा हटाया जा सकता है- (i) आयन विनिमय विधि, (ii) धावन सोडा (सोडियम कार्बोनेट) के उपचार से, (iii) केलगॉन विधि, (iv) संश्लेषित रेजिनविधि।
हाइड्रोजन परॉक्साइड (\[{{H}_{2}}{{O}_{2}}\]) - हाइड्रोजन परॉक्साइड
पर्यावरण -नियंत्रण में घरेलू तथा औद्योगिक बहि: स्राव (Effuents) का उपचार करने के लिए उपयोग में लिया जाता है। इसकी खोज 1818 र्इ. में थीनार्ड ( Thenard) ने की थी।
बनाने की विधियां -
(i) बेरियम परॉक्साइड को अम्लीकृत करके तथा जल की आधिक मात्रा को कम दाब पर वाष्पीकृत करके हाइड्रोजन परॉक्साइड का निर्माण किया जाता है।
(ii) उच्च वोल्टेज पर अम्लीकृत सल्फेट विलयन के विद्युत अपघटन होने पर ऑक्सीकरण प्रक्रिया से प्राप्त परॉक्साइड सल्फेट के जल-अपघटन से हाइड्रोजन परॉक्साइड का निर्माण होता है। इस विधि द्वारा प्रयोगशाला में (\[{{D}_{2}}{{O}_{2}}\]) का निर्माण किया जाता है।
(iii) हाइड्रोजन परॉक्साइड का औद्योगिक उत्पादन 2-एल्किल ऐन्थ्रा क्विनॉल के स्वत: ऑक्सीकरण द्वारा किया जाता है।
उपयोग - (i) पूतिरोधी (Antiseptic) के रूप में परहाइड्रॉल (Peryhydrol) के नाम से उपलब्ध होता है। दैनिक जीवन में इसका उपयोग मंद कीटनाशी तथा बालों के विरंजन के रूप में किया जाता
(ii) उच्च कोटि के अपमार्जकों जैसे सोडियम परबोरेट तथा सोडियम परकार्बोनेट के निर्माण में एवं हाइड्रोक्यूनोन, टार्टरिक अम्ल, खाद्य-उत्पादों तथा औषधियों (सिफैलोस्पोरिन) के संश्लेषण में इसका उपयोग किया जाता है।
(iii) उद्योगों में \[{{H}_{2}}{{O}_{2}}\]का उपयोग कागज की लुगदी, तेल, चमड़ा, वस्त्रों, वसा आदि के विरंजन कारक (Bleaching Agent) के रूप में किया जाता है।
(iv) वर्तमान समय में \[{{H}_{2}}{{O}_{2}}\] का उपयोग पर्यावरणीय रसायन
उदाहरण-पर्यावरण-नियंत्रण में, सायनाइड के ऑक्सीकरण में, वाहित मल के लिए वायुजीवी दशाओं पुनर्स्थापन, घरेलू तथा औद्योगिक बहिस्राव (Effuents) के उपचार में किया जाता है।
You need to login to perform this action.
You will be redirected in
3 sec
